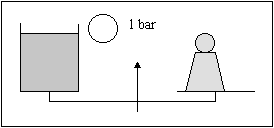
Prenons une enceinte close dont la pression ambiante est de 1 bar, contenant une balance très précise, une cuve remplie d’eau et des poids. Réalisons l’équilibre de la balance :
1. Introduction
Ce cours (intéresse le plongeur car il) présente la loi sur la dissolution des gaz dans les liquides, une loi qui a des conséquences importantes pour nous car elle explique tous les accidents biochimiques qui ont pour propriété commune la présence de différents gaz dans l’organisme. Ces gaz ne sont pas arrivés dans le sang puis dans d’autres tissus par hasard. Ils étaient présents dans l’air que le plongeur a respiré. Il existe donc un mécanisme qui permet aux gaz de passer dans le sang. Cette connaissance nous permettra aussi de déterminer à tout moment la quantité d’azote dissous dans nos tissus et donc de créer de tables de plongées.
2. Mise en évidence
Prenons une enceinte close dont la pression ambiante est de 1 bar, contenant une balance très précise, une cuve remplie d’eau et des poids. Réalisons l’équilibre de la balance :
Portons la pression ambiante de l’enceinte à 3 bars. Après un certain temps on observe que la balance n’est plus en équilibre. La cuve pleine d’eau est plus lourde. Il faut rajouter des poids pour rétablir l’équilibre. Portons la pression à 5 bars, nous observons le même phénomène. De plus, la quantité de poids qu’il faut rajouter est la même que pour passer de 1 à 3 bars.
Si nous ramenons la pression à 1 bar, la balance retrouve après un certain temps sa position initiale d ’équilibre. Il y a donc eu un échange entre le gaz et l’eau. La cuve est devenue « plus lourde » car l’eau à absorbé du gaz. Puisque nous pouvons revenir à l’état d’équilibre du début et que la variation de masse est proportionnelle à la variation de pression, il y a donc un lien direct entre la pression et la quantité de gaz dissous.
3. Définition
Certains corps ont comme propriété la possibilité d’en absorber d’autres. On parle alors de dissolution. Cette propriété dépend autant de la nature du corps soluble (air respiré) que de celle du solvant (corps humain), ainsi que de nombreux paramètres extérieurs provenant de l’environnement dans lequel à lieu le contact entre les deux corps.
C’est le physicien et chimiste anglais William Henry qui a défini la loi qui porte son nom en 1803. En voici la définition:
| «A température donnée et à saturation,
la quantité de gaz dissous dans un liquide est proportionnelle à la pression exercée par ce gaz sur le liquide». |
Remarque : pour éviter toute confusion avec la pression qu’exerce le gaz en question à la surface du liquide, on utilise le terme de tension pour le gaz dissous. C’est une quantité de gaz, pas une pression. Les échanges à la surface du liquide se font dans les deux sens en permanence. C'est pour cela que nous parlons d’équilibre.
4. Qu’est-ce que la saturation?
L’être humain est composé de 70% d’eau. Il faut donc considérer nos tissus comme étant des liquides ayant des propriétés diverses. Un plongeur est dans l’un des trois états suivants:
- La saturation : la quantité de gaz dissous est en équilibre avec le gaz à la surface.
- La sous-saturation : la tension du gaz dissous est inférieure à la pression du gaz libre.
- La sursaturation : la tension du gaz dissous est supérieure à la pression du gaz libre.
La sursaturation critique est atteinte lorsque la pression du gaz libre diminue brutalement et les molécules de gaz dissoutes dans le liquide remonte rapidement vers la surface (boisson pétillante). Si la variation de pression est trop grande, des bulles peuvent se former en grand nombre dans le liquide (accident de décompression).
5. Facteurs influents
La quantité de gaz absorbé par le liquide, donc par le corps humain (70% de liquide), dépend de nombreux facteurs. En voici la liste avec un parallèle avec la plongée:
- La pression : augmentation de la quantité de gaz dissous avec la pression. La pression croissant avec la profondeur, il y a plus d’azote dans le sang. Les paliers seront donc plus longs car il faudra désaturer plus longtemps.
- La durée d’exposition : la dissolution n’est pas instantanée (règle de type exponentielle). Cela explique la courbe de sécurité. On peut plonger à 40 mètres et ne pas avoir de palier à faire (sauf celui de sécurité de 3 minutes à 3 mètres).
- La nature du liquide : le corps humain est composé de divers tissus pour lesquels les vitesses de dissolution sont différentes. L’azote se retrouvera en quantités différentes dans le sang, les os, les graisses...
- La nature du gaz : Plus le coefficient de solubilité du gaz est élevé, plus le gaz se dissout. L’Azote est plus soluble que d’autres gaz, comme l’Hélium par exemple qui est quatre fois moins soluble. On comprend donc pourquoi il existe pour la plongée profonde des mélanges ternaires utilisant l’Hélium.
- La température : plus la température augmente plus la quantité de gaz dissous diminue et inversement. Le froid est donc un facteur aggravant pour la plongée, il faut donc sensibiliser le débutant à indiquer au chef de palanquée le fait qu’il a froid.
- L’agitation : le renouvellement du liquide au contact du gaz accélère la vitesse de dissolution. Un effort important durant la plongée modifie les paramètres de dissolution. Voila pourquoi il y a des tables professionnelles et des tables sportives.
- La surface de contact : une plus grande surface implique une vitesse de dissolution plus grande. Les poumons représentent une surface de 100 m2 environ. Cette surface est stable donc ce facteur n’intervient pas.
6. Démonstration par l’exemple
Pour bien comprendre l’action de tous ces facteurs sur notre organisme, nous allons faire une analogie avec les boissons gazeuses. Nous préférerons le Coca Cola ou la limonade au champagne car les gaz contenus dans celui-ci sont dus à une fermentation et non à l’adjonction de gaz carbonique sous pression. Le Coca Cola est fait de sirop mélangé à de l’eau et qui est ensuite mis sous pression.
Expliquez les phénomènes suivants en donnant le facteur principal:
- Que se passe-t-il lorsqu’on ouvre la bouteille de Coca Cola?
- Que se passe-t-il lorsqu’on secoue la bouteille de Coca Cola?
- Que se passe-t-il lorsque l’eau chauffée commence à frémir dans la casserole?
- Pourquoi vaut-il mieux utiliser des flûtes plutôt que des coupes pour le champagne?
- Est-il vrai que le fait de mettre une petite cuillère en métal dans le goulot de la bouteille de champagne permet de garder les bulles?
- Pourquoi utilise-t-on un seau rempli de glaçons pour conserver le champagne?
- Pourquoi les bulles partent du fond de la coupe de champagne?
7. Bilan
La dissolution augmente quand:
| Facteurs | Action | Lien avec la plongée |
| Pression |
ä |
Quand la profondeur augmente |
| Durée d’exposition |
ä |
Durée de la plongée |
| Nature du liquide |
N.a. |
Cela dépend du tissu concerné (sang, muscles, lymphe, graisses, os...) |
| Nature du gaz (solubilité) |
ä |
Solubilité plus grande pour l’azote que pour l’hélium (mélanges ternaires) |
| Température |
æ |
Quand la température du corps diminue (froid) |
| Surface de contact |
ä |
Les alvéoles pulmonaires représentent 100m2 (facteur stable!) |
| Agitation |
ä |
L’irrigation sanguine augmente (efforts) |
Auteur: Stéphane ROCHON
http://www.aquanaute.com/PlongezLoisir/theorie/physique/henry.htm